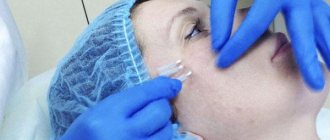
О процедуре
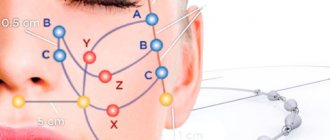
Особенность методики – в технике введения филлеров. Доктор вводит препарат не объемно, а «канально», вдоль определенных линий, формируя таким образом сеть из тонких микротоннелей, заполняемых препаратом.
В течение 8-12 месяцев происходит полное рассасывание сетки, а на ее месте будет сформирован собственный коллагеновый каркас из натуральных волокон, которые не только удерживают ткани от провисания и создают видимый эффект подтяжки, но и предупреждают появление новых складок и морщин.
Векторный лифтинг кожи лица выполняется препаратами Restylane и Radiesse.
Restylane – филлер на основе гиалуроновой кислоты высокой плотности. При введении аккумулирует молекулы воды, создавая объем и устраняя морщины. В составе препарата только гиалуроновая кислота, препарат абсолютно безопасен, имеет минимум противопоказаний и со временем рассасывается.
Radiesse (Радиесс) – инъекционный препарат на основе гидроксиапатита кальция, используется для моделирования лица и коррекции морщин. Гидроксиапатит кальция по своему составу аналогичен костной ткани, он на 100% совместим с организмом и со временем рассасывается.
Помимо создания подкожного каркаса, не дающего коже «сползать» вниз, препараты также запускают естественный процесс регенерации кожи и стимулирует образование нового собственного коллагена. Новые волокна коллагена сделают кожу более плотной и упругой, обеспечивая долгосрочный омолаживающий эффект.
[block:webform=client-block-3356]
Что собой представляет гидроксилапатит?
Долгое время считалось, что гидроксилапатит Ca10(PO4)6(OH)2 — идеальный в плане биосовместимости материал для восстановления поврежденных костей и зубов. Первая документированная попытка использовать ГАП в качестве остеозамещающего материала относится к 1920-м годам. Однако успешное применение ГАП в указанных целях совершилось только через 60 лет. Гидроксилапатит прекрасно совместим с мускульной тканью и кожным покровом; после имплантации он может напрямую срастаться с костной тканью в организме. Высокая биосовместимость гидроксилапатита объясняется кристаллохимическим подобием искусственного материала костному «минералу» позвоночных.
Название минерала происходит от греческого «апатао» — обманываю, поскольку красиво окрашенные природные разновидности апатитов часто путали с бериллами и турмалином. Несмотря на очень широкий спектр окраски природных апатитов, вызванных различными примесями, низкая твердость (он является эталоном значения 5 по 10-балльной шкале Мооса) не позволяет рассматривать его как полудрагоценный поделочный камень.
Известно, что костный минерал содержит в заметном количестве (~8% по массе) карбонат-ионы; существует также природный минерал сходного состава — даллит. Считается, что карбонат-ионы могут занимать две разные позиции в структуре ГАП, замещая гидроксил и/или фосфат-ионы с образованием карбонатгидроксилапатита (КГАП) А- и Б-типа, соответственно. Апатит биологического происхождения относится к Б-типу. Замещение фосфат-ионов карбонат-ионами приводит к уменьшению размеров кристаллов и степени кристалличности ГАП, а это сильно затрудняет исследование природных биоминералов. Увеличение доли карбонат-ионов в составе гидроксилапатита вызывает закономерные изменения в равновесной форме кристалла. Игольчатые кристаллы «сплющиваются» до пластин, которые очень похожи на кристаллиты существующего в организме апатита [5]. Таким образом, внесением в синтезируемый минерал небольшой доли карбонат-ионов можно получить материал, аналогичный биогенному и по химическому составу, и геометрически.
Важной характеристикой ГАП является стехиометрия его состава, которую принято выражать соотношением Ca/P. Переменный состав вызван тем, что при синтезе ГАП из раствора нельзя защититься от ионов H3O+ и HPO42−, которые могут замещать соответственно ионы Са2+ и РО43− в кристаллической структуре гидроксилапатита.
Показания к векторному лифтингу
Векторный лифтинг предназначен для коррекции возрастных изменений в возрасте от 30 до 55 лет.
Методика позволяет решить такие задачи, как:
- коррекция овала лица и устранение брылей;
- устранение морщин;
- подтяжка кожи за счет восстановления пропорций лица;
- гармонизация внешности (коррекция средней трети лица, скул и подбородка);
- профилактика возрастных изменений.
Филлеры также подходят для коррекции шеи и омоложения рук. Для коррекции более выраженных возрастных изменений биоармирование может быть дополнено аппаратными методиками.
Противопоказания
- Противопоказанием является наличие острого и/или хронического воспаления либо инфекции в месте проведения процедуры.
- Средство противопоказано пациентам с гиперчувствительностью к любому из компонентов.
- Противопоказано для пациентов, склонных к воспалительным реакциям кожи, или пациентам с тенденцией к гипертрофическим рубцам.
- Не имплантируйте продукт в эпидермис и не используйте в качестве заменителя кожи. Имплантация его в эпидермис или поверхностные слои дермы может привести к осложнениям, таким как образование фистул, инфекциям, экструзиям, формированию узлов и затвердению.
- Не предназначено для применения с целью коррекции глабеллярных складок. Более высокий риск локального некроза связан с глабеллярной инфекцией. Осложнения, связанные с другими инъецируемыми веществами, указывают, что интенсивные инъекции в поверхностные дермальные сосуды глабеллярной области могут вызвать ретроградное перемещение в артерии сетчатки, что может привести к окклюзии сосудов.
- Противопоказано при наличии инородных тел, например, жидкого силикона или других фракционных материалов.
- Не следует применять в зонах с недостаточным покрытием здоровой тканью с хорошей васкуляризацией.
- Не следует применять для пациентов с системными расстройствами, которые могут привести к плохому заживлению раны или повреждению тканей над имплантатом.
Как проводится процедура
Если противопоказаний для инъекций нет, доктор, вскрывает при пациенте упаковку с филлером, обрабатывает кожу антисептиком и приступает к введению препарата.
Неприятные ощущения могут быть только при первом контакте кожи с иглой, на той глубине, куда вводится препарат – болевых рецепторов нет. Но по желанию пациента место инъекций можно обезболить анестезирующим гелем.
Процедура биоармирования лица занимает 30-60 минут. После инъекций может быть небольшая припухлость и отечность тканей, которая проходит в течение 2-3 дней.
Как используется гидроксилапатит?
Существуют различные методы синтеза гидроксилапатита. Их можно условно разделить на высоко- и низкотемпературные. Высокотемпературные методы не представляют для нас большого интереса, так как полученные таким образом материалы практически не биоактивны. Низкотемпературные методы можно разделить на две большие группы: гидролиз (в том числе так называемые гидротермальные методы синтеза) и осаждение из раствора. Интересен так же комбинированный метод так называемого золь–гель синтеза. В нем сухой остаток геля подвергается разложению при относительно невысокой температуре 400–700 °С (по сравнению с высокотемпературным синтезом). Материалы, полученные таким образом, представляют собой твердую, пористую керамику, по химическому составу и физическим свойствам напоминающую минерал кости.
Комплексный эффект
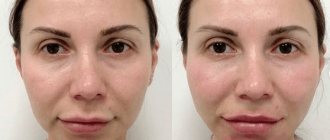
Результат процедуры можно оценить сразу после процедуры, пациенты отмечают:
- уменьшение птоза;
- увеличение плотности кожи;
- уменьшение брылей;
- значительно меньшую выраженность носогубных складок;
- более четкий овал лица.
Отдаленные результаты обусловлены синтезом нового коллагена, его цикл составляет 21 день, именно поэтому можно говорить о наиболее выраженном результате омоложения спустя 3-4 недели после процедуры.
Эффект биоармирования сохраняется 1-2 года.
ПОДГОТОВКА К РАБОТЕ ИЗДЕЛИЯ
Указания по использованию
Для процедуры подкожной инъекции требуется следующее:
- Шприц(ы) с инъецируемым имплантатом Radiesse™ (Радиес) (поставляются отдельно)
- Игла(ы) нужного калибра с люэровскими коннекторами (не входят в комплект поставки). Необходимый размер иглы составляет 25 ga — 27 ga, 1/2 — 11/2 дюймов. Применение игл с калибром диаметра менее 27 может увеличивать риск закупорки иглы.
1) Подготовьте пациента для подкожной инъекции с использованием стандартных методов. Место инъекции следует пометить с помощью хирургического маркера и подготовить с применением соответствующего антисептического средства. По усмотрению врача следует использовать локальную или местную анестезию в месте инъекции либо седацию. После анестезии приложите лед, чтобы уменьшить опухание/растяжение.
2) Перед подкожной инъекцией подготовьте шприцы и иглы. Для каждого шприца следует использовать новую иглу, либо одну иглу можно подсоединять к каждому новому шприцу для одного и того же пациента.
Извлеките упаковку из фольги коробки. При необходимости упаковку можно открыть и положить шприц в стерильное поле. Для стерилизации в пакете из фольги обычно наличествует небольшое количество влаги; это не является признаком повреждения.
Преимущества клиники ЕМС
Процедуру должен проводить исключительно врач-дерматокосметолог. Только сертифицированный специалист знает все тонкости метода и способен правильно определить глубину и место введения препарата.
В Эстетической клинике EMC специалисты виртуозно выполняют процедуру векторного лифтинга кожи. Мы придерживаемся принципа естественности: коррекция не исказит ваших черт лица, а только подчеркнет красоту лица и скорректирует возрастные изменения так, чтобы никто не догадался о проведенной коррекции.
Данная техника прекрасно сочетается с аппаратными anti-age методиками. На личной консультации доктор ответит на все ваши вопросы и поможет составить комплексную программу омоложения.
Какие же проблемы решают препараты на основе гидроксиапатита кальция?
Препарат признан эффективным для применения в области носогубных складок, где проблема образования глубоких морщин стоит особенно остро. Морщины марионетки, идущие от уголков рта вниз к подбородку, также хорошо убираются гидроксиапатитом кальция. Объемное моделирование мы уже упоминали, также стоит отметить эффективность препарата для омоложения кожи рук.
Несмотря на хорошо зарекомендовавший себя эффект и отсутствие противопоказаний, применение препаратов с гидроксиапатитом кальция все же чревато иногда осложнениями. Как и все филеры, препарат может привести к инфекциям, отекам и гематомам. При неверно выбранной глубине введения, препарат может дать эффект мертвенно-бледного лица. Если вводить препарат в непредназначенные для него зоны, например, в носослезную борозду или губы, могут образоваться комки, синяки и неровности, которые будут рассасываться очень долгое время. Слишком близкое к поверхности введение чревато появлением белых полос, которые останутся, пока препарат не рассосется самостоятельно.
Таким образом, в руках неграмотного специалиста препарат способен привести к плачевным последствиям, от которых сложно избавиться. И, напротив, при применении опытным сертифицированным врачом, гидроксиапатит кальция поможет успешно восстановить утраченные объемы и продлить молодость.
Часто задаваемые вопросы
Векторный лифтинг – это больно?
Для тех пациентов, кто не первый раз обращается к врачу-косметологу и не понаслышке знает о том, что такое биоревитализация и контурная пластика, векторный лифтинг покажется намного более комфортной процедурой. Небольшие болевые ощущения присутствуют лишь при прокалывании кожи. Непосредственно армирование – совершенно безболезненная техника, так как на этой глубине нет болевых рецепторов. Во время процедуры выполняется не более десяти крошечных проколов, по желанию с применением анестезирующего крема, которым мы обрабатываем области введения препарата. Гель вводится специальной иглой либо канюлей векторно, именно поэтому процедура получила название векторного лифтинга. Наиболее часто биоармирование выполняется препаратами Restylane Vital и Radiesse.
В чем отличие векторного лифтинга от контурной пластики?
Главная цель векторного лифтинга – за счет создания каркаса вернуть ткани на прежнее место и заново смоделировать четкий овал лица. Контурная пластика направлена на восполнение утраченного объема в области скул, щек, висков.
Как реагирует организм на кальций-фосфатную керамику?
Биоактивность — комплексная характеристика совместимых с организмом материалов, учитывающая, помимо воздействия на биологические процессы роста и дифференциации клеток, также:
- скорость растворения материала в средах, создаваемых определенными группами клеток (биорезорбируемость);
- скорость осаждения материала из межтканевой жидкости на поверхность материала.
Среди требований, которые предъявляются к биоактивным материалам, применяемым в медицинской практике для восстановления целостности костной ткани, на первом месте стоят относительно высокая скорость растворения (порядка десятков мкм в год) — так называемая биорезорбируемость. Активную роль в биохимических реакциях, протекающих на границе раздела кость/имплантат с участием клеток специфических для процесса остеосинтеза, играет поверхность. Говоря о скорости резорбции материала, находящегося в межтканевой жидкости, принято сравнивать новые материалы с уже используемыми в медицине — керамикой на основе гидроксилапатита или β-трикальцийфосфата. Крупнокристаллическая керамика на основе ГАП резорбируется медленно, так что включения искусственного материала можно обнаружить в кости и через много лет. Керамика, полученная с использованием β-Ca3(PO4)2, растворяется столь быстро, что растущая кость не успевает заполнить образующиеся полости. Скорость растворения материала зависит от множества факторов: площади поверхности, строения, состава, дефектности материала. Эти характеристики определяют отклик организма на инородный имплантат. Биоактивные материалы характеризуются быстрым срастанием с костной тканью через образование промежуточного слоя ГАП, образующегося двумя возможными путями:
- Растворение фосфата кальция — осаждение гидроксилапатита.
- Осаждение ГАП из пересыщенного раствора в тканевой жидкости.
Важная процедура оценки биоактивности подразумевает тестирование in vivo. Это дорого и долго, а также сопряжено с риском. Однако ведется активная разработка методик, позволяющих уже на раннем этапе доклинических испытаний ранжировать материалы по степени биоактивности в ходе относительно простых экспериментов in vitro, моделирующих процессы в организме человека — растворение материала и осаждение ГАП на поверхности материала из растворов, подобных жидкостям организма.
Исследование биоактивности материалов проводят с использованием раствора, имитирующего ионный состав межтканевой жидкости человека. Компактные образцы исследуемого материала помещают в раствор на несколько суток при 37 °С. Процесс осаждения карбонатгидроксилапатита из модельного раствора на поверхность материала контролируют методами рентгенофазового анализа, ИК-спектроскопии и растровой электронной микроскопии.
Существует необходимость регулировать биорезорбируемость искусственных материалов, в зависимости от их назначения. Такая возможность существует благодаря различию свойств материалов с разным составом. Чтобы сделать образец более резорбируемым, нужно увеличить долю карбонат- и силикат-ионов в кристаллической решетке материала.
Рисунок 3. Ажурный слой частично резорбированной керамики. Снимок со сканирующего электронного микроскопа. Здесь изображен фрагмент материала, подвергнутый растворению в модельном растворе in vitro. Справа можно увидеть, каким был материал до начала резорбции.
Наилучшую биоактивность в таких исследованиях проявляет кремнийсодержащий материал. На его поверхности образуются силанольные (—SiOH) группы, активно участвуя в минерализации внешнего слоя имплантата. Такой материал интенсивно обменивается ионами с раствором: силанольные группы прочно связывают ионы кальция, способствуя формированию слоя аморфного фосфата кальция на поверхности, расслоение и кристаллизация которого приводит к образованию ажурного слоя, состоящего из частиц ГАП размером ~10 нм (рис. 3). Различия в толщине такого слоя могут служить мерой биоактивности материала: чем он толще, тем проще кость будет встраивать этот материал в свою структуру.
Еще одним из важнейших свойств современных имплантационных материалов является остеоиндуктивность — способность поддерживать жизнедеятельность остеобластов и стимулировать эктопическое (вне кости) образование костной ткани de novo. Это важнейшее свойство для искусственных имплантов. Дело в том, что для инициации костеобразования вокруг импланта необходимо микроокружение частицами живой кости. Вновь образующаяся кость постепенно срастается с окружающими имплантированными частицами, «перескакивая» с одной на другую.
Считается, что наиболее активным с точки зрения остеосинтеза является аморфная модификация гидроксилапатита. Однако в достаточной степени кристалличный ГАП с размерами кристаллитов, приближающимися к размерам кристалла в костной ткани (20–40 нм3), может показывать результаты на порядок выше аморфных цементов, использующихся в настоящее время [6].
Биоинертные материалы никак не влияют на процесс остеосинтеза. На поверхности изготовленных из них имплантатов происходит образование фиброзной ткани, препятствующей образованию связи имплантата с костью. Существует значительная вероятность отторжения таких материалов организмом, часто сопровождающегося воспалительными процессами. Тем не менее, полностью отказаться от этих материалов пока нельзя, поскольку они дешевы и легки в обработке. Основные проблемы, которые решаются при проектировании имплантатов из биоинертных материалов, — приближение упругих характеристик имплантата к характеристикам кости, а также снижение скорости коррозионных процессов.
В отличие от биоинертных синтетических материалов на основе полимеров и металлов, керамика на основе фосфатов кальция биосовместима и биоактивна, а значит, является наиболее перспективным материалом для костных имплантатов. Главным ее недостатком является хрупкость. Пока что наилучшим выходом является применение композитов из покрытых кальцийфосфатной керамикой металлов или полимеров (рис. 4). Они хорошо обеспечивают интеграцию материала в костную ткань, не позволяя образовываться фиброзной ткани вокруг биоинертного металла. Со временем протез очень прочно срастется с окружающей костью, которая заменит слой ГАПа. Процент отказа таких протезов значительно ниже, чем у металлических и пластиковых аналогов.
Рисунок 4. Покрытие из биоактивной керамики на протезе тазобедренного сустава. а — Пористая структура керамического покрытия. б — Рентгеновский снимок протеза, имплантированного на место тазоберенного сустава. Сам протез изготовлен из титана и полимеров.
[9] и Insurers pay twice as much as hospitals for hip and knee implants